新闻中心
News Center
2025版《中国药典》重磅更新!新版药典核心变化抢先看

浏览次数:1701

发布时间:2025-04-17
本文来源:化工仪器网
《中国药典》是国家药品标准的重要组成部分,是国家药品标准体系的核心,亦是药品生产、检验、使用、监管的基本遵循和法定依据。自第十二届药典委员会成立以来,历经5 年时间,在各级药品检验机构、科研院所、学会协会的支持和配合下,全体药典委员认真落实 “四个最严 ”的要求,依托药品标准提高行动计划,终于组织完成了2025 年版《中国药典》编制工作。

中国药典
近日,国家药监局发布公告,正式颁布 2025 版《中华人民共和国药典》(以下简称《中国药典》),并明确自 2025 年 10 月 1 日起施行。目前,国家药监局、国家卫生健康委已发布2025年版《中国药典》1-4部目录,在药品标准、质量控制等方面带来了一系列核心变化,包括但不限于药品名称调整,药包材标准同步更新,药品注册标准、农药残留、重金属检测更严格,接轨国际标准,引入ICH Q4B方法等。
一、品种收载有调整
2025年版《中国药典》收载品种总计6385 种,呈现出 “有增有减” 的态势。品种新增 159 种,涵盖了多个领域,包括我国自主研发的抗癌药注射用洛铂和注射用三氧化二砷、双价人乳头瘤病毒疫苗( 大肠埃希菌)和 13 价肺炎球菌多糖结合疫苗(破伤风类毒素/白喉类毒素);在国际上率先收载我国自主研发且拥有自主知识产权的聚乙二醇化人生长激素注射液和金培生长激素注射液品种标准;首次收载利妥昔单抗、英夫利西单抗、曲妥珠单抗、贝伐珠单抗、阿达木单抗 5 个生物类似药标准;增加了儿童用药标准收载,将仿制药质量和疗效一致性评价成果在药典标准中体现,临床用药的质量得到进一步保障。此外,药典还修订了 1101 项品种,不再收载品种 32 项。‘’
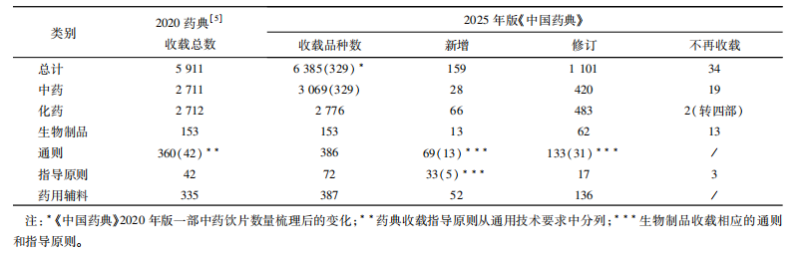
2025年版《中国药典》制修订整体情况
同时,在中药领域,一部中药收载品种共计 3069 种,新增 28 种,如三七止血颗粒等,同时不再收载 19 种非药用饮片;二部化学药收载品种共计 2776 种,新增 66 个化学药品品种,聚焦临床急需领域,如抗肿瘤药物以及心血管与代谢疾病药物等;三部生物制品收载品种共计 153 种,新增 13 种;四部收载药用辅料共计 387 种,新增 52 种。品种收载的调整,充分体现了以临床应用为导向,不断满足临床用药需求的理念。
新版药典品种收载坚持以临床应用为导向,持续扩大国家基本药物目录和基本医疗保险用药目录品种的覆盖,进一步提升临床常用药品质量的可控性。
品种收载详情可于附件《中国药典》目录内查询。
二、质量控制更严格
中药安全性提升:在中药方面,对于中药材及饮片禁用农药残留控制由原 33 种(55 个单体)大幅增加至 47 种(72 个单体)。根据 GB 2763 - 2021《食品安全国家标准 食品中农药最大残留限量》要求,新增枸杞子、人参等 10 种中药材品种相应的农药残留限量标准。同时,增加 54 个中药材与饮片品种的重金属及有害元素限量要求,例如黄芪、槟榔药材增加了赭曲霉毒素 A 检查项,麸炒薏苡仁饮片项下增加黄曲霉毒素、玉米赤霉烯酮检查项等,全面提升了中药材及饮片的安全性。

2025 年版《中国药典》制剂通则制修订情况
化药杂质控制强化:化学药品重点加强了杂质的控制要求。持续开展杂质定性定量研究,完善有关物质分离方法,更加关注杂质的来源与分类,合理进行杂质的控制。 2025 年版《中国药典》对收载的 110 多个品种标准的有关物质检查项目进行了增修订,并且增加了对基因毒性杂质进行必要评估的提示,进一步保障化学药品的质量安全。
生物制品标准完善:完善了《生物制品生产用动物细胞基质制备及质量控制》《人用疫苗总论》等通则(总论),同时收载了《9403 人用疫苗杂质控制指导原则》,指导疫苗研制和已上市产品的质量控制。例如,三部收载的 23 价肺炎球菌多糖疫苗等 7 个疫苗中不再添加抑菌剂,降低了疫苗接种后产生不良反应的潜在风险,提升了疫苗的安全性。
三、接轨国际标准
ICH Q4B 相关指导原则转化实施:对 ICH 相关指导原则,与欧、美、日等药典进行对比研究后,通过直接协调和并行收载的方式,实现 ICH Q4B 全部 16 个指导原则在 2025 年版《中国药典》中的转化实施。如在《0861 残留溶剂测定法》《0862 元素杂质》通则等方面进行了完善和新增,修订《9101 分析方法验证指导原则》《9098 不确定度评定指导原则》等,使得 2025 年版《中国药典》在药品关键质量控制要求方面与国际标准更加协调一致。
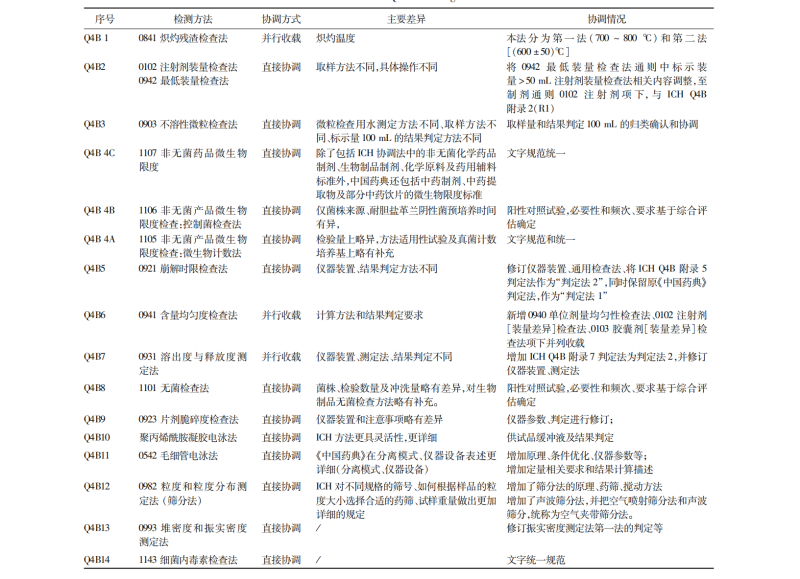
ICH Q4B 相关指导原则在 2025 年版《中国药典》转化情况
体外实验替代体内实验推进:按照国际 “3R” 原则,推进体外生物学方法取代动物试验法。在《人用疫苗总论》《9301 注射剂安全性检查法应用指导原则》等总论和指导原则中规定了基于风险评估实施异常毒性检查的要求,更好地与国际要求衔接,也为企业简化放行检验提供了可能性。
四、新技术新方法应用
药品有效性控制升级:新版药典在药品有效性控制方面对标欧美药典,加强统一协调。《0931 溶出度与释放度测定法》新增 “往复架法” 和 “扩散池法”,为口服固体制剂质量一致性评价和相关特定剂型质量评价提供了更丰富的方法;新增《1402 放射性药品生物分布测定法》,填补国内空白;首次收载《9404 基于基因修饰细胞系的生物检定法指导原则》,推动转基因技术产品研制和质控;新增《9405 糖蛋白的糖基化分析指导原则》,为抗体药物的有效性评价提供技术支撑等。
药品安全性控制加强:在安全性控制方面也有诸多创新。在国际上率先新增收载《3309 热原检查法(报告基因法)》,与传统家兔热原实验法相比,该法不使用动物,灵敏度高,稳定性好;新增《9110 微生物全基因组测序技术指导原则》,为生产用菌毒种检定、外源因子污染检查等提供指导;新增《9016 注射剂可见异物控制指导原则》,加强高风险制剂生产过程控制;基于细胞治疗产品特点,新增《9406 细胞类制品微生物检查指导原则》,解决细胞治疗产品放行检查的技术瓶颈。
药品质控技术储备强化:首次新增针对中药辐照检测方法,采用酶联免疫胶体金技术用于真菌毒素检测,建立植物生长调节剂检测法,为中药安全性控制提供有效检测手段。新增《9024 蛋白质组学分析方法以及微生物全基因组测序》通则等,持续完善分子生物学检测技术要求在药典的收载。新增《9095 多变量统计过程控制技术指导原则》《9096 化学计量学指导原则》,为实现全过程质量控制提供规范的检测技术支撑。
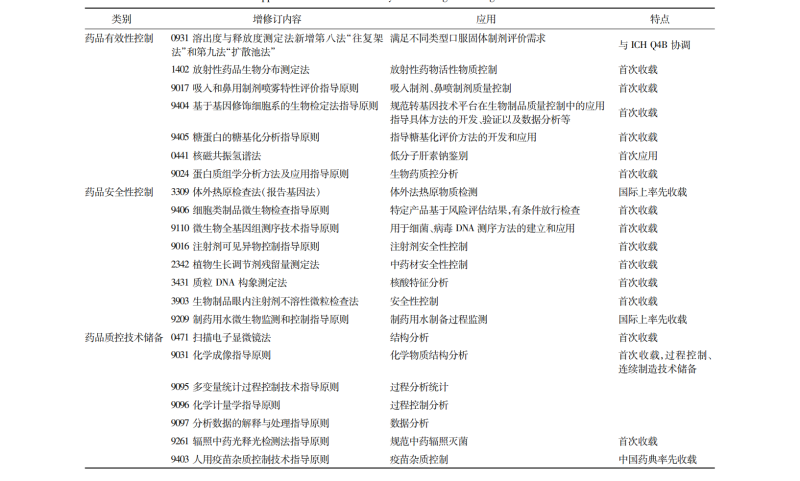
先进分析检测技术在 2025 年版《中国药典》的应用
2025 版《中国药典》的这些核心变化,进一步强化了药品质量管控,推进了国际标准接轨,引入了多项创新技术,对于保障公众用药安全有效、促进医药产业高质量发展具有重大意义。医药行业相关企业和从业者需密切关注这些变化,积极做好应对和调整,以适应新版药典的要求 。


